Yn ôl y ffordd gysylltu asid amino a siwgr, gellir rhannu peptid siwgr yn bedwar categori: O glycosylation, C a N glycosylation, saccharification gwlith a GPI (glycophosphatidlyinositol) cysylltiad.
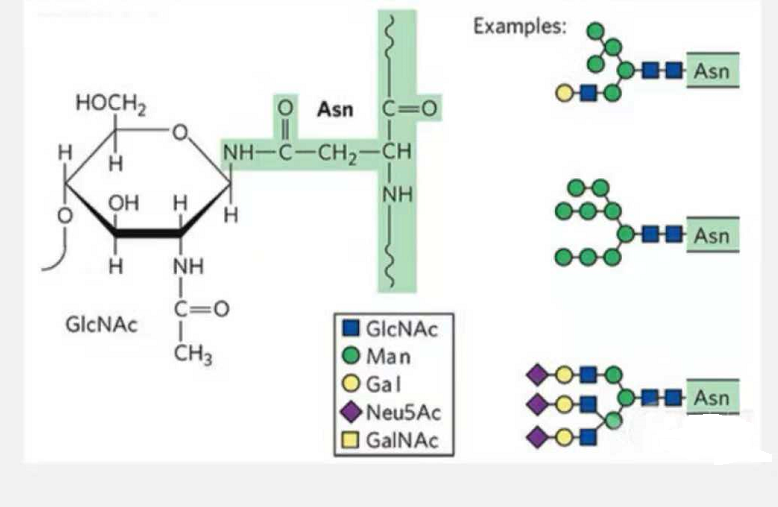
1. Mae glycopeptidau N-glycosylation yn cynnwys glwcos N-acetamid ar ddiwedd lleihau'r gadwyn glycan (Glc-Nac) sy'n gysylltiedig â'r atom N ar grŵp amid cadwyn ochr rhywfaint o Asn yn y gadwyn peptid, a'r Asn rhaid lleoli'r gallu i gysylltu'r gadwyn glycan yn yr AsN-X-Ser /Thr (X! =P) yn y motiff a ffurfiwyd gan y gweddillion.Mae'r siwgr yn N-acetylglucosamine.
Glycopeptide strwythurol wedi'i addasu gan N-glycosylation
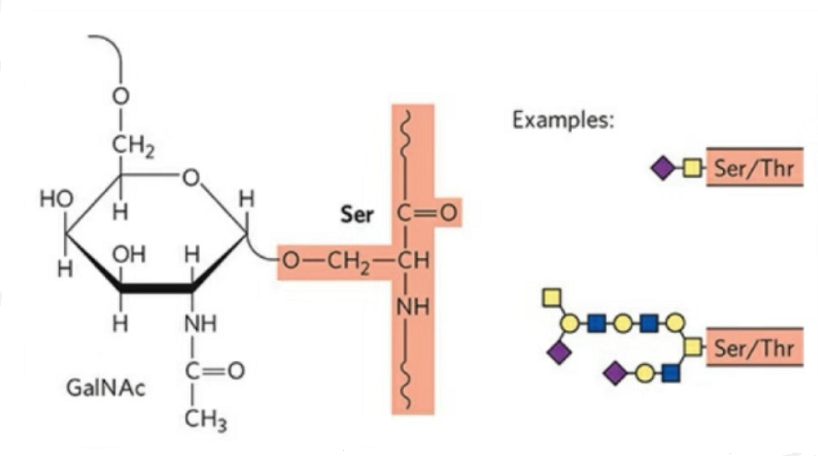
2. Mae strwythur O-glycosylation yn symlach na N-glycosylation.Yn gyffredinol, mae'r glycopeptid hwn yn fyrrach na'r glycan, ond mae ganddo fwy o fathau na N-glycosylation.Yn gyffredinol, gellir glycosyleiddio Ser a Thr yn y gadwyn peptid.Yn ogystal, mae glycopeptidau wedi'u haddurno â tyrosine, hydroxyl, a glycosylation hydroxyproline.Y safle cyswllt yw'r atom ocsigen hydrocsyl ar gadwyn ochr y gweddillion.Y siwgrau cysylltiedig yw galactos neu N-acetylgalactosamine (Gal&GalNAc) neu glwcos / glwcosamin (Glc / GlcNAc), mannose / mannosamine (Man / ManNAc), ac ati.
Mae O-glycosylation yn addasu'r strwythur
3. Glycopeptide O-GlcNAC glycosylation ((N-acetylcysteine (NAC))) (glcnAcN-acetylglucosamine/acetylglucosamine)
Mae un glycosylation N-acetylglucosamine (GlcNAc) yn cysylltu proteinau O-GlcNAc ag atom ocsigen hydrocsyl y serine neu'r threonin sy'n weddill o brotein.Mae glycosyleiddiad O-GlcNA yn addurn monosacarid O-GlcNAc heb estyniad glycan;Fel ffosfforyleiddiad peptid, mae glycosylation O-GlcNAc o glycopeptidau hefyd yn broses addurno protein deinamig.Gall addurniad annormal O-GlcNAc achosi amrywiaeth o afiechydon megis diabetes, clefydau cardiofasgwlaidd, tiwmorau, clefyd Alzheimer ac yn y blaen.
Pwyntiau glycosyleiddiad glycopeptidau
Mae strwythurau sylfaenol cadwyni polypeptid a siwgr wedi'u cysylltu â chadwyni protein gan fondiau cofalent, a gelwir y safleoedd sy'n cysylltu'r cadwyni siwgr yn safleoedd glycosyleiddiad.Gan nad oes templed i ddilyn biosynthesis cadwyni siwgr glycopeptid, bydd gwahanol gadwyni siwgr yn cael eu cysylltu â'r un safle glycosyleiddiad, gan arwain at yr hyn a elwir yn anhomogenedd microsgopig.
Glycosyleiddiad glycopeptidau
1. Effaith glycosyleiddiad glycopeptid ar therapi-effeithiolrwydd proteinau therapiwtig
Yn achos proteinau therapi-therapiwtig, mae glycosylation hefyd yn effeithio ar hanner oes a thargedu cyffuriau protein in vivo
2. glycosylation glycopeptide hydawdd a phroteinau
Mae astudiaethau wedi dangos y gall cadwyni siwgr ar wyneb proteinau wella hydoddedd moleciwlaidd proteinau
3. Glycopeptide glycosylation ac imiwnogenigrwydd protein
Ar y naill law, gall cadwyni siwgr ar wyneb proteinau ysgogi ymatebion imiwn penodol.Ar y llaw arall, gall cadwyni siwgr orchuddio rhai arwynebau ar yr wyneb protein a lleihau ei imiwnogenedd
4. Glycopeptide glycosylation sy'n cynyddu sefydlogrwydd protein
Gall glycosyleiddiad gynyddu sefydlogrwydd proteinau i wahanol amodau dadnatureiddio (fel dadnatureiddio, gwres, ac ati) ac osgoi agregu proteinau.Ar yr un pryd, gall y cadwyni siwgr ar wyneb proteinau hefyd gwmpasu rhai pwyntiau diraddio proteolytig moleciwlau protein, a thrwy hynny gynyddu ymwrthedd proteinau i broteinasau
5. Glycopeptide glycosylation sy'n effeithio ar weithgaredd biolegol moleciwlau protein
Gall newid glycosyleiddiad protein hefyd alluogi moleciwlau protein i ffurfio gweithgareddau biolegol newydd
Amser postio: Awst-03-2023